寿险保障
临床试验责任保险(全球多中心)
详细信息
管理复杂的全球多中心临床试验保险
一:保险保障不足可能导致临床试验延迟以及审批过程受阻,产生高昂的代价。
考虑在境外进行临床试验的申办方通常是 出于患者招募、经济、研究和监管等原 因,但在决定地点时,考虑潜在的保险影 响也是至关重要的。不同国家的保险要求 大不相同,对临床试验的保险要求也是如此。
在决定并购买特定国家的保险保障时,即使是最勤勉的试验申办方也可能会失误。申办方可能会在无意中偏离当地保险法规,让自己承担过多责任,或在不知情的 情况下购买远超出特定国家要求的保险限额。后果可能很严重。与保险保障不足的 相关问题可能会导致临床试验项目审批过 程受阻,延迟临床试验启动计划,并可能进一步导致专利保护期被缩短,由此产生 高昂的代价。
由于境外临床试验的复杂性,为申办方提 供保险服务的的保险公司应不仅在中国而 是在世界各地都具有属地服务的能力,同 时拥有相关服务经验,并且能够在开展试 验的特定国家提供满足当地保险合规要求 的保障并具备专注生命科学行业的理赔专长。
境外临床试验的风险
多种因素促成了在境外开展试验的决定。 有可能是因为所研究的疾病主要集中在某 些特定的地区。有可能是因为处方药在中 国的广泛使用,很难找到足够多未接受过 治疗的受试者。亦或一些国家要求必须先 在当地进行临床试验,药物或医疗器械才 能获批在该国销售。
经济方面的考量也起着相当大的作用。东欧或印度等地区具备高质量的医院和医疗 设施,但研究的总体成本通常远低于中国。以上这些因素造成大量研究在中国以 外的国家或地区开展。
对于试验申办方而言,一个重大的责任风 险是,正在研发的药物或医疗器械可能会 导致人身伤害。然而,当临床试验在境外进行时,申办方还需考虑特定国家的法律 环境、与试验相关的法规、保障范围,以及对责任限额的要求。例如,在一些欧盟 国家,规定的责任限额可高达每位患者 600万欧元,但在其他国家则要低得多。
无论试验在何处开展,都必须遵守一个或多个监管机构的规定,比如国家卫生当局、欧洲药品管理局、美国食品药品监督 管理局。例如,美国食品药品监督管理局要求聘请一名调查员定期报告,并由医院 的机构审查委员会对试验进行监督。在欧盟,伦理委员会扮演着类似角色。
除了针对临床试验的监管要求外,保险所 适用的法律以及法律在实践中被解读的方式都可能存在差异。特定地区可能有针对保单条款的特定准则,监管机构、伦理委员会、合同研究组织或试验中心研究者可能对保单条款都有不同的解读
例如,是否需要延长报告期可能取决于正在研发的药物或医疗器械,以及有关当局 对准则的解释。在这种情况下,虽然法律 并没有特别要求,但试验相关方或监管机 构却有可能会要求延长报告期。同意这些 条款可能会显著增加试验申办方的责任风险。俄罗斯,东欧,欧洲大陆,南美等许多地区或国家都要求保单应由获得当地许可或 能够本地出单的保险公司出具。这意味着申办方在中国出具的保单不仅不能在发生 损失时提供属地服务,而且还会使申办方面临不合规的风险。此外,申办方还可能会面临税务违规风险。例如,对于在印度造成损失的索赔,印度一直严格要求确保 缴纳税款,即使保单并非印度保单,且索赔是在印度以外进行赔付的。2 再者,有很多国家都要求索赔在当地进行处理,比 如意大利。 关于不断变化的法规如何影响临床试验,我们有一个印度的例子。2013年,印度最高法院命令中央政府即时改变临床知情同意的程序,要求对印度所有临床试验参与 者的知情同意访谈进行录像,并且最高法 院积极关注政府批准试验的过程。3 对于在试验期间发生的伤害或死亡,印度发布了较严苛的责任规定。4 新的法规对临床试验的风险产生了改变
合同和知情同意书中的风险管理
无论试验在何处开展,管理责任风险的关 键点是申办方与合同研究组织、研究人员 和试验中心达成的合同。 合同条款通常包括合同研究组织的声明和 保证,即他们具备开展研究的专业知识、 招募合适受试者的能力,并由具备资质的 机构来主持试验。合同条款还包括出具结 果以及提交相关监督管理的时间。 申办方密切关注合同措辞至关重要,以避 免承担比预期更多的责任或同意不必要或 单方面赔偿条款。申办方应确保合同研究 组织所要求的保险限额适用于相关国家, 并确保保障包括医疗责任保障(如适用)。 合同安排的一个关键部分是知情同意书。 知情同意书必须证明受试者已明确同意参 加实验药物或医疗器械的试验,并充分意 识到参与试验的固有风险。同意书必须以 受试者能理解的措辞起草。知情同意书和 试验风险应当面向受试者进行说明。讨论 和签字应有见证。这些步骤对于减少潜在 责任至关重要。
当地理赔和监管知识
在处理东欧、印度、南美或非洲等其他国家/地区的索赔时,具有当地理赔服务能力至关重要。文化差异和法律问题一样,都都容易给理赔造成难题。在许多国家,试验期间发生的任何伤害事故都可能成为 申办方需要面临的责任,即使受试者在与试验无关的事故中受伤,而只是因为该事故发生在试验中心。即使在某些细分的药品和器械领域,境外临床试验发生的索赔数量不多,但实际发生的索赔金额巨大。为减少索赔风险,了解当地法律程序,与当地律师建立关系,并了解文化期待至关重要。
二:一家具有丰富经验的、为世界各国临床试验提供保障的保险公司可以帮助申办方解决可 能出现的复杂问题
申办方还需了解试验所在国的监管框架,因其适用于临床试验和保险。未购买合适 的保险可能会使申办方面临重大药品和医 疗器械责任索赔。如果合同知情同意程序 出现失误,申办方可能会承担严重责任。 限额不足和保单措辞不当可能会造成试验 启动延迟或试验停止,从而导致获批延迟 和将新产品推向市场的严重延迟。
驾驭复杂风险
与临床试验相关的风险因国家而异。在一个国家所面临的风险可能比在另一个国家 大得多。一家具有丰富经验的、为世界各 国临床试验提供保障的保险公司可以帮助申办方解决可能出现的复杂问题。保险公司不仅应该在全球范围内拥有经验,还应该在进行试验的国家拥有相关经验。保险公司与当地律师建立关系有助于减轻索赔风险并确保以最恰当的方式处理索赔。由于可能发生重大索赔,申办方应寻求与一家公认的具有稳健财务实力的保险公司合作。在国外进行临床试验往往是最好的选择,但申办方应认识到恰当的保险保障是研发过程中对风险进行审慎管理的关键。
临床试验责任保险案例
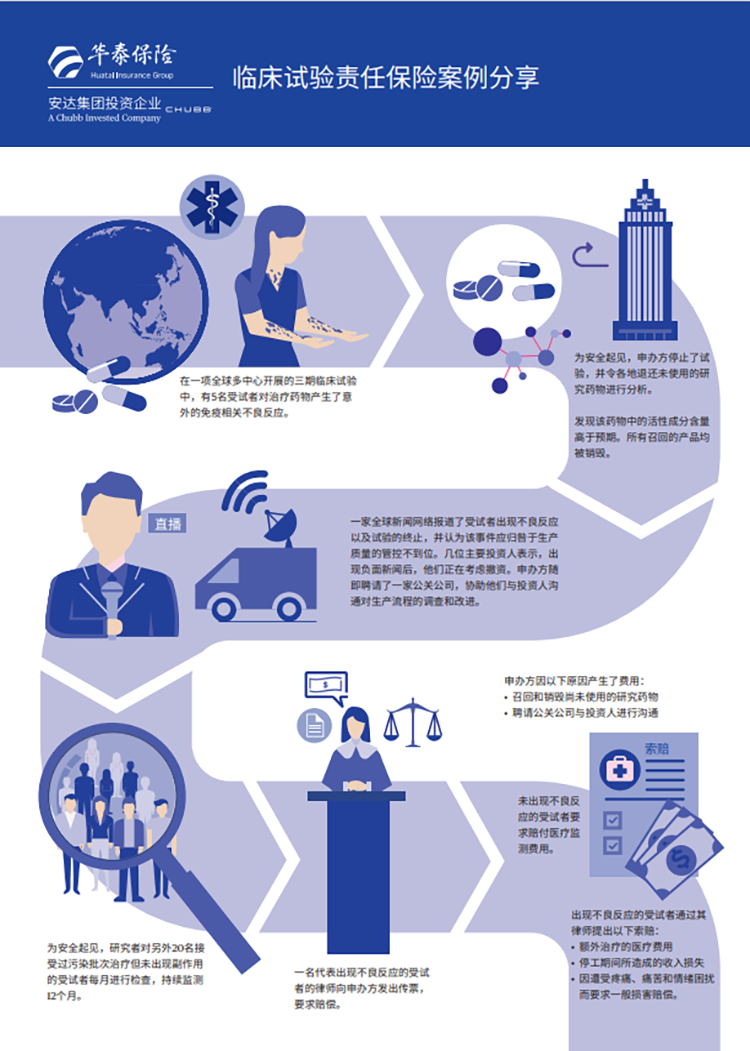

尾注 :
1. 趋势、图表和地图,Clinical Trials. gov,数据截至2016年5月。来源 : https://clinicaltrials.gov/ct2/ resources/trends
2. 印度对Adidas保险索赔征税,华尔街日 报,2011年3月23日。来源 : http://online.wsj.com/news/articles/ SB100014240527487040502045762181 3245 4647812?mg=reno64-wsj
3. 印度最高法院强制要求在临床试验中对 知情同意进行录像,ScienceInsider, 2013年10月22日。来源 : http://news.sciencemag.org/ asiapacific/2013/10/indiassupremecourt-mandates-videotapedconsent clinical-trials
4. 印度对药物试验的规定引发对行业健康 的担忧,金融时报,2013年11月18日。 来源 : http://www.ft.com/ intl/cms/ s/0/76335e22-4d03-11e3-9f40 00144feabdc0.html
一:保险保障不足可能导致临床试验延迟以及审批过程受阻,产生高昂的代价。
考虑在境外进行临床试验的申办方通常是 出于患者招募、经济、研究和监管等原 因,但在决定地点时,考虑潜在的保险影 响也是至关重要的。不同国家的保险要求 大不相同,对临床试验的保险要求也是如此。
在决定并购买特定国家的保险保障时,即使是最勤勉的试验申办方也可能会失误。申办方可能会在无意中偏离当地保险法规,让自己承担过多责任,或在不知情的 情况下购买远超出特定国家要求的保险限额。后果可能很严重。与保险保障不足的 相关问题可能会导致临床试验项目审批过 程受阻,延迟临床试验启动计划,并可能进一步导致专利保护期被缩短,由此产生 高昂的代价。
由于境外临床试验的复杂性,为申办方提 供保险服务的的保险公司应不仅在中国而 是在世界各地都具有属地服务的能力,同 时拥有相关服务经验,并且能够在开展试 验的特定国家提供满足当地保险合规要求 的保障并具备专注生命科学行业的理赔专长。
境外临床试验的风险
多种因素促成了在境外开展试验的决定。 有可能是因为所研究的疾病主要集中在某 些特定的地区。有可能是因为处方药在中 国的广泛使用,很难找到足够多未接受过 治疗的受试者。亦或一些国家要求必须先 在当地进行临床试验,药物或医疗器械才 能获批在该国销售。
经济方面的考量也起着相当大的作用。东欧或印度等地区具备高质量的医院和医疗 设施,但研究的总体成本通常远低于中国。以上这些因素造成大量研究在中国以 外的国家或地区开展。
对于试验申办方而言,一个重大的责任风 险是,正在研发的药物或医疗器械可能会 导致人身伤害。然而,当临床试验在境外进行时,申办方还需考虑特定国家的法律 环境、与试验相关的法规、保障范围,以及对责任限额的要求。例如,在一些欧盟 国家,规定的责任限额可高达每位患者 600万欧元,但在其他国家则要低得多。
无论试验在何处开展,都必须遵守一个或多个监管机构的规定,比如国家卫生当局、欧洲药品管理局、美国食品药品监督 管理局。例如,美国食品药品监督管理局要求聘请一名调查员定期报告,并由医院 的机构审查委员会对试验进行监督。在欧盟,伦理委员会扮演着类似角色。
除了针对临床试验的监管要求外,保险所 适用的法律以及法律在实践中被解读的方式都可能存在差异。特定地区可能有针对保单条款的特定准则,监管机构、伦理委员会、合同研究组织或试验中心研究者可能对保单条款都有不同的解读
例如,是否需要延长报告期可能取决于正在研发的药物或医疗器械,以及有关当局 对准则的解释。在这种情况下,虽然法律 并没有特别要求,但试验相关方或监管机 构却有可能会要求延长报告期。同意这些 条款可能会显著增加试验申办方的责任风险。俄罗斯,东欧,欧洲大陆,南美等许多地区或国家都要求保单应由获得当地许可或 能够本地出单的保险公司出具。这意味着申办方在中国出具的保单不仅不能在发生 损失时提供属地服务,而且还会使申办方面临不合规的风险。此外,申办方还可能会面临税务违规风险。例如,对于在印度造成损失的索赔,印度一直严格要求确保 缴纳税款,即使保单并非印度保单,且索赔是在印度以外进行赔付的。2 再者,有很多国家都要求索赔在当地进行处理,比 如意大利。 关于不断变化的法规如何影响临床试验,我们有一个印度的例子。2013年,印度最高法院命令中央政府即时改变临床知情同意的程序,要求对印度所有临床试验参与 者的知情同意访谈进行录像,并且最高法 院积极关注政府批准试验的过程。3 对于在试验期间发生的伤害或死亡,印度发布了较严苛的责任规定。4 新的法规对临床试验的风险产生了改变
合同和知情同意书中的风险管理
无论试验在何处开展,管理责任风险的关 键点是申办方与合同研究组织、研究人员 和试验中心达成的合同。 合同条款通常包括合同研究组织的声明和 保证,即他们具备开展研究的专业知识、 招募合适受试者的能力,并由具备资质的 机构来主持试验。合同条款还包括出具结 果以及提交相关监督管理的时间。 申办方密切关注合同措辞至关重要,以避 免承担比预期更多的责任或同意不必要或 单方面赔偿条款。申办方应确保合同研究 组织所要求的保险限额适用于相关国家, 并确保保障包括医疗责任保障(如适用)。 合同安排的一个关键部分是知情同意书。 知情同意书必须证明受试者已明确同意参 加实验药物或医疗器械的试验,并充分意 识到参与试验的固有风险。同意书必须以 受试者能理解的措辞起草。知情同意书和 试验风险应当面向受试者进行说明。讨论 和签字应有见证。这些步骤对于减少潜在 责任至关重要。
当地理赔和监管知识
在处理东欧、印度、南美或非洲等其他国家/地区的索赔时,具有当地理赔服务能力至关重要。文化差异和法律问题一样,都都容易给理赔造成难题。在许多国家,试验期间发生的任何伤害事故都可能成为 申办方需要面临的责任,即使受试者在与试验无关的事故中受伤,而只是因为该事故发生在试验中心。即使在某些细分的药品和器械领域,境外临床试验发生的索赔数量不多,但实际发生的索赔金额巨大。为减少索赔风险,了解当地法律程序,与当地律师建立关系,并了解文化期待至关重要。
二:一家具有丰富经验的、为世界各国临床试验提供保障的保险公司可以帮助申办方解决可 能出现的复杂问题
申办方还需了解试验所在国的监管框架,因其适用于临床试验和保险。未购买合适 的保险可能会使申办方面临重大药品和医 疗器械责任索赔。如果合同知情同意程序 出现失误,申办方可能会承担严重责任。 限额不足和保单措辞不当可能会造成试验 启动延迟或试验停止,从而导致获批延迟 和将新产品推向市场的严重延迟。
驾驭复杂风险
与临床试验相关的风险因国家而异。在一个国家所面临的风险可能比在另一个国家 大得多。一家具有丰富经验的、为世界各 国临床试验提供保障的保险公司可以帮助申办方解决可能出现的复杂问题。保险公司不仅应该在全球范围内拥有经验,还应该在进行试验的国家拥有相关经验。保险公司与当地律师建立关系有助于减轻索赔风险并确保以最恰当的方式处理索赔。由于可能发生重大索赔,申办方应寻求与一家公认的具有稳健财务实力的保险公司合作。在国外进行临床试验往往是最好的选择,但申办方应认识到恰当的保险保障是研发过程中对风险进行审慎管理的关键。
临床试验责任保险案例


尾注 :
1. 趋势、图表和地图,Clinical Trials. gov,数据截至2016年5月。来源 : https://clinicaltrials.gov/ct2/ resources/trends
2. 印度对Adidas保险索赔征税,华尔街日 报,2011年3月23日。来源 : http://online.wsj.com/news/articles/ SB100014240527487040502045762181 3245 4647812?mg=reno64-wsj
3. 印度最高法院强制要求在临床试验中对 知情同意进行录像,ScienceInsider, 2013年10月22日。来源 : http://news.sciencemag.org/ asiapacific/2013/10/indiassupremecourt-mandates-videotapedconsent clinical-trials
4. 印度对药物试验的规定引发对行业健康 的担忧,金融时报,2013年11月18日。 来源 : http://www.ft.com/ intl/cms/ s/0/76335e22-4d03-11e3-9f40 00144feabdc0.html
上一篇:网络安全保险
下一篇:没有了
下一篇:没有了
相关产品


